BUENOS DÍAS
Fecha: 11 de agosto
Temas: Modelos atómicos
Evidencia:
Desarrollo: Realizar lo consignado en el blog
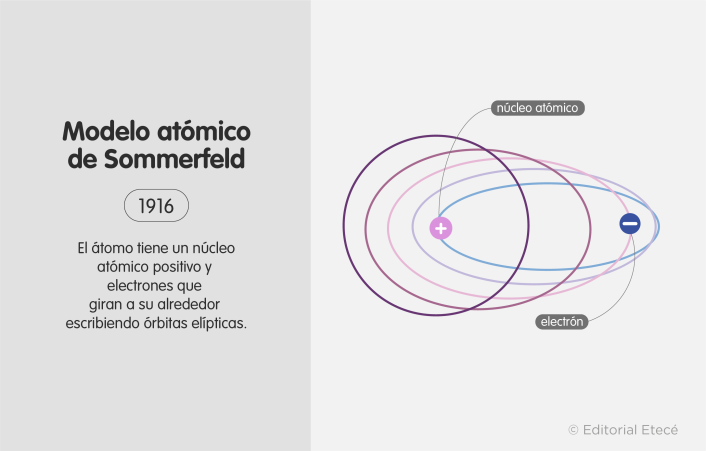
Modelo atómico de Sommerfeld (1916)
Este modelo fue propuesto por Arnold Sommerfield para intentar cubrir las deficiencias que presentaba el modelo de Bohr, especialmente para corregir la suposición de Bohr que plantea que los electrones describen órbitas circulares.
El modelo de Sommerfeld se basó en parte de los postulados relativistas de Albert Einstein.
Los postulados de este modelo son:
- Los electrones describen órbitas circulares y elípticas alrededor del núcleo.
- Existen subniveles de energía en cada nivel de energía del átomo.
- Los electrones representan corrientes eléctricas minúsculas.
Modelo atómico de Schrödinger (1926)
El modelo atómico de Schrödinger, propuesto por Erwin Schrödinger a partir de los estudios de Bohr y Sommerfeld, concebía los electrones como ondas de materia, lo cual permitió la formulación posterior de una interpretación probabilística de la función de onda (magnitud que sirve para describir la probabilidad de encontrar a una partícula en el espacio) por parte de Max Born.
Eso significa que se puede estudiar probabilísticamente la posición de un electrón o su cantidad de movimiento, pero no ambas cosas a la vez, debido al Principio de Incertidumbre de Heisenberg.
Este es el modelo atómico vigente a inicios del siglo XXI, con algunas posteriores adiciones. Se le conoce como “Modelo cuántico-ondulatorio”.
Aun así, este modelo tiene algunas deficiencias, por ejemplo:
- Schrödinger no tiene en cuenta el espín electrónico (momento angular intrínseco de las partículas elementales).
- No tiene en cuenta los efectos relativistas de los electrones rápidos.
- No explica por qué un electrón en un nivel de energía superior, decae a un nivel de energía inferior.
Modelo atómico actual
El modelo atómico que se utiliza en la actualidad para representar la estructura y las propiedades del átomo está enmarcado en la mecánica cuántica no relativista, y se basa en el modelo propuesto por Schrödinger, en el espín electrónico y en el Principio de exclusión de Pauli, que plantea que dos electrones no pueden tener sus cuatro números cuánticos iguales.
Los electrones se consideran ondas de materia en el modelo atómico actual. Alrededor del núcleo atómico, los electrones están distribuidos en regiones llamadas orbitales atómicos, que se definen como las regiones donde es más probable encontrar un electrón alrededor del núcleo. Por otra parte, en este modelo, la energía y el momento angular del electrón no pueden tener cualquier valor, sino que solo pueden tomar valores permitidos, por lo que se dice que están cuantizados.
Utilizando la ecuación de Schrödinger se pueden predecir los valores de energía y momento angular asociados a un electrón, y el cuadrado de la función de onda asociada determina los orbitales atómicos.
Algunos postulados del modelo atómico actual son:
- El electrón se representa por su espín, su masa y su carga eléctrica negativa.
- El electrón tiene comportamiento onda-partícula.
- Las regiones permitidas para el electrón están determinadas por la función de onda, y el cuadrado de esta representa la probabilidad de encontrar a un electrón alrededor del núcleo.
- Un mismo estado representado por los números cuánticos n (número cuántico principal), l (número cuántico azimutal) y m (número cuántico magnético) puede estar ocupado solo por dos electrones, siempre que estos tengan espines contrarios. El espín es el cuarto número cuántico.